Studi biocristallografici ed elettrochimici di proteine redox
La catena respiratoria è costituita da una serie di trasportatori di elettroni (complessi), la maggior parte dei quali sono proteine integrali della membrana interna, contenenti gruppi prostetici in grado di accettare e di donare uno o due elettroni. Per investigare i meccanismi di formazione dei complessi macromolecolari e la loro rottura che segue il processo di trasferimento elettronico, si conducono studi strutturali su ferri(III)- e ferro(II)-citocromo c da cuore di cavallo, usando lo ione nitrato come probe anionico per mappare le variazioni redox dipendenti della superficie elettrostatica. Per ottenere informazioni sul meccanismo di trasferimento elettronico che avviene tra gruppi eme, si studiano le strutture cristallografiche di proteine "citocromi c dieme".
In questo contesto si inseriscono anche studi elettrochimici su proteine di trasporto elettronico. Le molecole di Citocromo c, sia di cuore di cavallo che di lievito (ycc), vengono adsorbite su self-assembled monolayers (SAMs) su elettrodi di Au policristallino e studiati tramite tecniche elettrochimiche, allo scopo di determinare i parametri termodinamici del trasferimento elettronico Fe(III)/Fe(II) in differenti condizioni sperimentali (temperatura, pH del buffer, agenti denaturanti, natura del SAM).
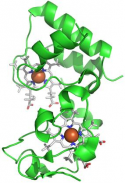 | 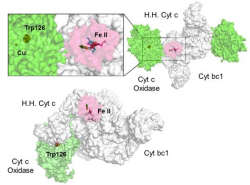 |  |
High resolution crystal structure of the recombinant diheme cytochrome c from Shewanella baltica J. Biomol. Struct. Dyn. | Electron transfer complexes: the experimental mapping of the redox-dependent cytochrome c electrostatic surface supports the existence of the functional mitochondrial supercomplex iii-iv (respirosome) J. Inorg. Biochem. | Cyclic voltammetry for the unfolded His-His form of yeast cyt c adsorbed on a polycrystalline Au electrode coated with some self-assembled monolayer at increasing partial pressure of O2. Chem. Commun., 2011, 47, 11122 |
Gruppo di ricerca
| Gruppo Proteine redox |