Il Dipartimento di Scienze Chimiche e Farmaceutiche è partner del progetto EPIC
EPIC - EPigenetics of Immunity in Cancer
ll cancro è una malattia ad alta incidenza nell'area coperta dal programma di cooperazione Interreg V-A ItaliaÖsterreich. Questo determina una forte pressione sui bilanci sanitari anche in relazione ai costi delle nuove terapie. Una problematica da affrontare con urgenza riguarda la possibilità di sostenere un'assistenza sanitaria di alta qualità evitando gli sprechi e l'inefficienza.
Il progetto EPIC affronterà questo problema e svilupperà soluzioni migliorative e più sostenibili per le terapie anticancro. Un approccio integrato che non si basa solo sullo sviluppo di nuovi farmaci. EPIC si concentrerà anche sul miglioramento dei metodi per prevedere l'efficacia dei farmaci nell'immunoterapia.
Istituti di ricerca italiani ed austriaci, con percorsi di eccellenza e competenze complementari (Chimica, Medicina, Biologia e Bioinformatica), daranno origine alla rete EPIC per fornire nuovi progressi all'immunoterapia anticancro e per favorire la diffusione di conoscenze aperte ed accessibili agli stakeholder dei territori interessati quali: le accademie, le strutture cliniche e la cittadinanza. Il programma di ricerca è pienamente integrato e conforme agli obiettivi del RIS3 (specializzazioni innovative regionali) "smart health" per la regione Friuli-Venezia Giulia e per l' Alto Adige/Sud Tirolo così come del Life Science Strategy (WISS 2025) per il Salisburghese.
Mentre circa il 10% dei casi di cancro origina da fattori genetici, la maggior parte degli altri casi sono causati da fattori esterni come la dieta, l’uso di tabacco, le infezioni, l'esposizione a radiazioni e ai composti chimici. Questi fattori esterni possono comunque causare modificazioni epigenetiche, cioè modificazioni dei cromosomi che non comportano alterazioni della sequenza del DNA.
Le alterazioni epigenetiche possono avvenire in geni che codificano per soppressori dei tumori, citochine immunosuppressive e proteine di controllo, compromettendo in questo modo l’attivazione della risposta immunitaria antitumorale.
Tra le più comuni modificazioni epigenetiche si ha l’acetilazione/deacetilazione degli istoni, proteine associate al DNA nella cromatina. L’acetilazione e deacetilazione degli istoni controllano la trascrizione genica modificando la struttura della cromatina: l’acetilazione rilassa la struttura della cromatina rendendo il DNA più accessibile agli enzimi coinvolti nella trascrizione, portando infine all’attivazione della trascrizione genica. Al contrario, la deacetilazione rende più compatta la cromatina, rallentando la trascrizione genica.
Il progetto EPIC (Epigenetics of Immunity in Cancer) riguarda l’inibizione delle istone deacetilasi (HDACs), gli enzimi responsabili della deacetilazione degli istoni. L’inibizione di questi enzimi porta al mantenimento degli istoni nella forma acetilata e riattiva quindi i geni che portano alla risposta immunitaria antitumorale, sostenendo così il system immunitario nella sua lotta al cancro.
Le attività del consorzio EPIC sono iniziate nel settembre 2019 e coinvolgono le Università di Udine (Lead Partner), Trieste, Salisburgo, ed Eurac Research a Bolzano. I biologi dell’Università di Udine studiano l’effetto di inibitori di HDACs identificati da fonti commerciali. I ricercatori dell’Università Paris-Lodron di Salisburgo studiano l’effetto di inibitori selezionati sul sistema immunitario in modelli cellulari e in organi artificiali. I bioinformatici di Eurac Research misurano le differenze tra cellule tumorali in presenza ed in assenza degli inibitori utilizzando tecniche di sequenziamento di prossima generazione e analizzano i dati generati dal consorzio. I chimici bio-organici dell’Università di Trieste progettano e sintetizzano nuovi potenziali inibitori delle HDACs.
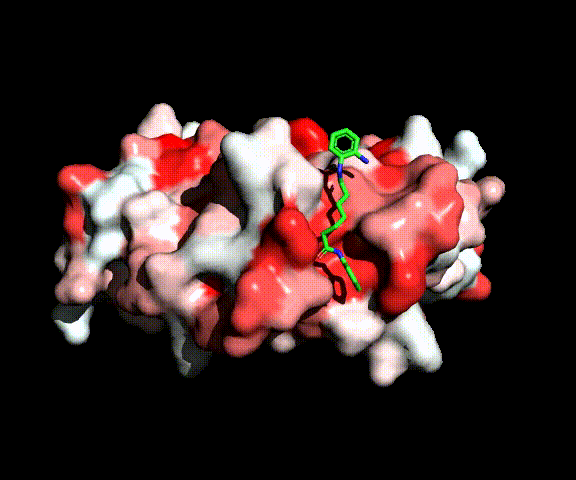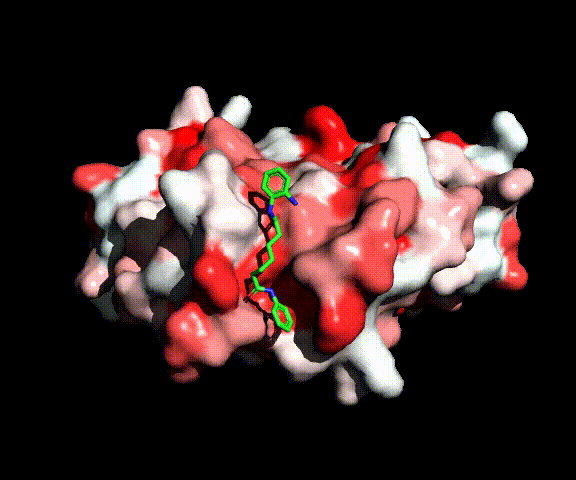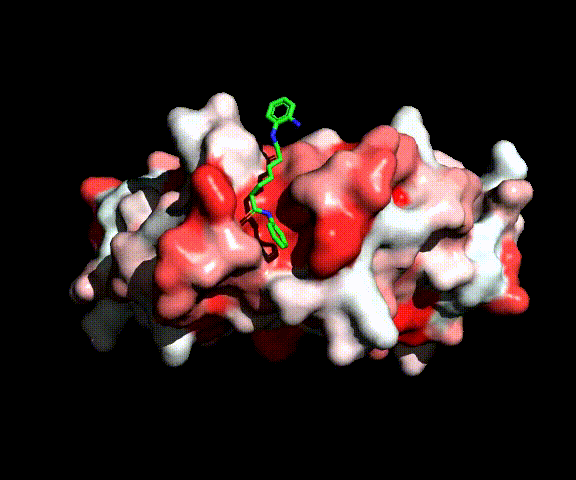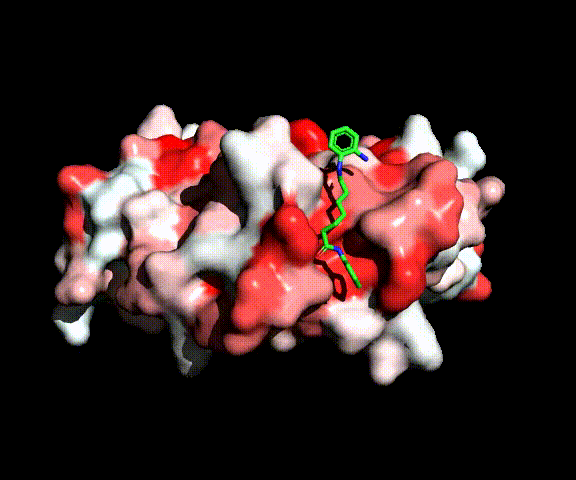
Complesso tra MEF2 e l’inibitore delle HDAC BML210 (verde)
All’inizio del progetto abbiamo verificato l’ipotesi di letteratura sull’attività inibitoria di diammidi dell’acido pimelico e suberico nel reclutamento della HDAC-2 da parte di MEF2. Abbiamo sintetizzato una serie di diammidi ottimizzate per legarsi a MEF2, ma prive del gruppo legante per lo zinco che è necessario per l’inibizione delle HDACs. Nessuno di questi composti ha, però, mostrato un’attività antitumorale significativa, indicando che, al contrario di quanto ipotizzato in letteratura, questo meccanismo d' inibizione delle HDAC è improbabile. Ciò è stato confermato da una valutazione delle energie di complessazione dei nuovi composti da parte di MEF2 che risultano meno favorevoli di un ordine di grandezza rispetto a quella per la formazione del complesso tra MEF2 e HDAC. L’attività inibitoria è stata invece ripristinata introducento un gruppo legante per lo zinco e ciò indica che anche le molecole di questa classe si comportano come gli inibitori convenzionali del sito catalitico se vengono equipaggiate di un gruppo legante per lo zinco.
Abbiamo quindi sintetizzato una serie di nuovi inibitori basati sulla struttura della diammide pimelica dell’inibitore BML210 nella quale sono stati introdotti differenti gruppi leganti per lo zinco. L’attività biologica di questi composti è stata valutata nella primavera del 2022 e, effettivamente, i composti si sono dimostrati attivi. Risulta quindi verosimile che essi interagiscano a livello del sito catalitico così come è in grado di fare l’inibitore HDAC8 in figura.
HDAC8 complexed with active site inhibitor SAHA
Dopo aver effettuato questa valutazione ed ottenuto questa conferma, abbiamo dedicato gli ultimi mesi del progetto alla progettazione e sintesi di una nuova serie di derivati sperabilmente più attivi che conservino la capacità di interagire a livello del sito catalitico e del canale di ingresso, ma che possano anche occupare il così detto subsito non classico di questi enzimi:
A questo scopo abbiamo considerato composti contenenti un nucleo diidropirimidinonico (DHMP), basandoci su nostre precedenti esperienze nella preparazione di inbitori di b-secretasi. I composti contengono un gruppo ureidico che, ulteriormente funzionalizzato con gruppi alcossilici, può fungere da zinc finger.
I composti sono stati sintetizzati ricorrendo alla reazione multi-componente di Biginelli, ottenendo una libreria di 10 potenziali inibitori:
L’attività sintetica si è conclusa in coincidenza con la conclusione del progetto e i composti sono stati consegnati al lead partner per le future misure di attività.
Partners
University of Udine (Lead Partner)
University of Trieste (PP1)
Paris Lodron Universität Salzburg (PP2)
Eurac Research Bolzano (PP3)
Duration
September 2019 - December 2022
Funding
Interreg V-A Italia - Osterreich
Total Budget
€ 940.370,54


